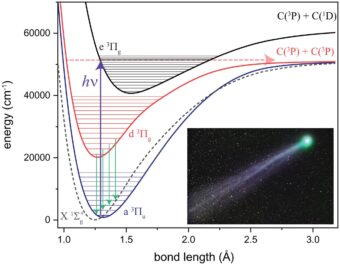
I livelli energetici della molecola biatomica del carbonio coinvolti nell’emissione delle bande di Swan (frecce verdi). La cometa nel riquadro è la Lovejoy (cliccare pe ringrandire). Crediti: Borsovszky et al., Pnas, 2021
Le molecole più semplici, con cui abbiamo a che fare continuamente ogni istante della nostra vita, sono quelle che respiriamo: le molecole di ossigeno e quelle di azoto composte, rispettivamente, da due atomi di ossigeno (O2) e due di azoto (N2). Anche il carbonio, l’elemento base delle complesse molecole alla base della vita, può formare una molecola biatomica (C2) che però è instabile nelle condizioni di temperatura e pressioni atmosferiche e non ne abbiamo un’esperienza diretta. Il C2 è stabile in condizioni di elevata rarefazione, come quelle che si hanno nella chioma delle comete. Anche una semplice molecola biatomica possiede diversi livelli di energia: ci sono i livelli di energia elettronici, determinati dalla distribuzione degli elettroni fra i due nuclei; i livelli vibrazionali determinati dalla distanza fra i due nuclei e i livelli rotazionali, dovuti alla rotazione dei due nuclei attorno al comune centro di massa. Tutti questi livelli energetici sono quantizzati, ossia è possibile passare da una livello energetico ad uno superiore (eccitazione) a patto che l’energia assorbita sia pari alla differenza di energia fra i livelli energetici possibili.
Quando la molecola del carbonio viene eccitata, può riemettere l’energia assorbita rilasciando radiazione elettromagnetica che l’occhio percepisce di colore verde. Si tratta di tutta una serie di righe note come “bande di Swan“, in onore del fisico scozzese William Swan il primo a studiare lo spettro del C2 nel 1856. La molecola di C2 non esiste nelle comete finché non si avvicinano al Sole. Quando il Sole inizia a riscaldare il nucleo della cometa, il ghiaccio di superficie sublima e con lui la materia organica ivi intrappolata che si sposta così nella chioma. Una volta nella chioma la luce solare scinde queste molecole organiche complesse, dando origine al carbonio biatomico.
Proprio in queste ultime settimane era visibile nei cieli italiani – prima all’alba e poi al tramonto – la bella cometa Leonard (C/2021 A1) che il prossimo 3 gennaio farà il passaggio al perielio a circa 92 milioni di km dal Sole. Se avete avuto l’opportunità di vedere le immagini che circolano sul Web avrete visto come la chioma delle cometa ossia la vasta atmosfera che circonda il nucleo, abbia uno spiccato colore verdastro, mentre la coda di ioni e di polveri tendono, rispettivamente, al blu e al giallo. Considerato che i due tipi di code che di solito mostra una cometa nascono entrambe dai materiali delle chioma per interazione con il vento e la pressione della radiazione solare sorge spontaneo chiedersi perché la coda di ioni non sia anch’essa di colore verde. La risposta – corretta – che si sono dati gli astronomi in passato era che prima di arrivare nella coda la molecola di carbonio viene dissociata a causa della radiazione UV solare, impedendo così l’emissione delle bande di Swan. Questa intuizione si deve al fisico Gerhard Herzberg che la concepì negli anni ’30. Poiché la molecola di C2 non è stabile, questa teoria è sempre stata difficile da dimostrare e la vita della molecola di C2 era stimata dagli astronomi in circa 24-30 ore alla distanza di 1 unità astronomica dal Sole.

Un’immagine della cometa Leonard ripresa il 21 dicembre 2021 dalla città di Swan Hill dello stato di Victoria in Australia. Il colore verde intenso della chioma è evidente. Crediti: M. Mattiazzo
Il processo di fotodissociazione della molecola di C2 non era mai stato osservato, almeno fino ad ora. Un gruppo di chimici guidato da Jasmin Borsovszky della Scuola di Chimica dell’Università del New South Wales (Sydney), ha pubblicato recentemente un paper sui Proceedings of the National Academy of Sciences (Pnas), in cui vengono esposti i risultati sperimentali ottenuti sulla fotodissociazione di questa elusiva molecola.
Il primo passo del complesso esperimento è stato ottenere il carbonio biatomico da una molecola più grande, il percloroetilene o C2Cl4, separandola dai suoi atomi di cloro (Cl) usando un laser Uv ad alta potenza. Il percloroetilene era immerso in un gas di elio alla pressione di 3 atmosfere fatto uscire da un ugello in modo tale da creare un fascio di molecole di C2 che è stato diretto verso una camera a vuoto, lunga circa due metri. Il team ha quindi puntato altri due laser Uv verso il fascio di C2: uno per dissociare la molecola, l’altro per rendere rilevabili i singoli atomi di carbonio. Conoscendo l’energia dei fotoni emessi dal laser per la dissociazione, misurando la velocità dei singoli atomi risultanti e usando la conservazione dell’energia è stato possibile misurare – per la prima volta con buona precisione – l’energia di legame dello stato fondamentale della molecola di C2, risultata di 602,8 kJ/mol. Con questo valore, conoscendo il numero di fotoni Uv a una data energia emessi dal Sole è stato possibile stimare una durata di circa 40 ore per le molecole di C2 che si trovano nelle chiome cometarie alla distanza di 1 unità astronomica. Un valore in buon accordo con quello determinato empiricamente dagli astronomi e che conferma il motivo per cui non esistono comete con le code verdi: le molecole di C2, nelle dure condizioni dello spazio interplanetario, hanno una vita troppo breve per arrivare intatte nella coda.
Ma i risultati dell’esperimento di Borsovszky e colleghi non finiscono qua. Il C2, anche se è tra le più semplici molecole biatomiche omonucleari, sta suscitando molto interesse fra i chimici principalmente per l’ipotesi che – fra i due atomi di carbonio – potrebbe esserci un legame quadruplo, contrariamente a quanto ci si aspetterebbe. In effetti la teoria qualitativa degli orbitali molecolari prevede un doppio legame e questo quadro non cambia molto dopo un trattamento quantitativo. Le moderne teorie del legame di valenza, così come il legame di valenza generalizzato, prevedono invece un triplo legame. Nel paper su Pnas i dati raccolti da Borsovszky e colleghi sono compatibili con un legame quadruplo: le meraviglie della semplice molecola di C2 non sono finite.
Per saperne di più:
- Leggi su Proceedings of the National Academy of Sciences l’articolo “Photodissociation of dicarbon: How nature breaks an unusual multiple bond”, di Jasmin Borsovszky, Klaas Nauta, Jun Jiang, Christopher S. Hansen, Laura K. McKemmish, Robert W. Field, John F. Stanton, Scott H. Kable e Timothy W. Schmidt




